DMLA : interdiction du médicament le moins cher
La Direction générale de la santé (DGS) a demandé aux agences régionales de santé (ARS) d’interdire l’utilisation de l’Avastin® dans le traitement de la dégénérescence maculaire liée à l’âge (DMLA), selon un communiqué publié le 30 juillet 2012. Une interdiction qui coûte très cher.
La dégénérescence maculaire liée à l’âge (DMLA) est une maladie qui altère très gravement la vision et qui se déclare vers 50 ans. Elle est due à une détérioration des cellules photoréceptrices de la macula, la zone centrale de la rétine. C’est la première cause de malvoyance chez les plus de 50 ans. En France elle concerne environ 1,5 million de personnes atteintes à des degrés divers.
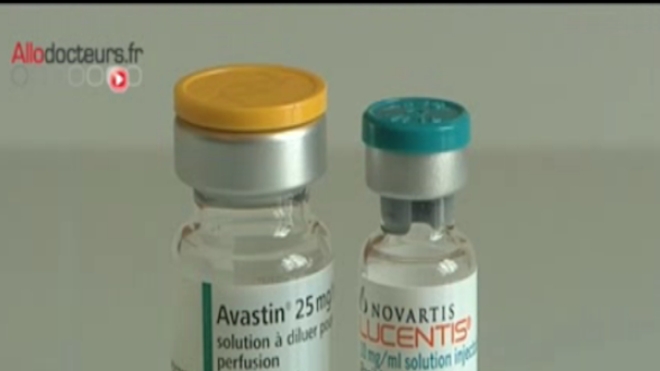
Il existe deux formes de DMLA. L'une dite « sèche », qui ne dispose pas de traitement, et une forme « humide », qui se soigne par une injection dans l’œil une fois par mois. Le traitement officiel s’appelle le Lucentis®. Récemment, des chercheurs ont montré qu’un autre produit, l’Avastin®, un anticancéreux, avait les même effets que le Lucentis® . Une seule différence entre les deux médicaments, mais de taille : leur prix. Une trentaine d’euros pour le premier, alors que le second coûte entre 800 et 1 200 euros l'injection mensuelle.
L’ennui c’est que l’autorisation de mise sur le marché de l’Avastin®, ne concerne que le traitement de certains cancers, digestifs notamment.
Dans son communiqué publié le 30 juillet 2012, la DGS rappelle que « la loi du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament, interdit la réalisation de préparations magistrales lorsqu’il existe déjà une spécialité pharmaceutique disposant de l’AMM », comme c’est le cas pour la DMLA. Elle rappelle donc aux services hospitaliers l’interdiction de l’utilisation de l’anticancéreux pour traiter la DMLA.
Plusieurs ophtalmologistes spécialisés se sont élevés contre cette décision, interdisant l'utilisation d'un médicament efficace et nettement plus économique.
En début de semaine, Marisol Touraine, la ministre de la santé s’est déclaré favorable à « une extension de l’autorisation de la mise sur le marché de l’Avastin® et le réexamen du prix du Lucentis® afin de préserver les impératifs de sécurité sanitaire tout en garantissant l’accès aux traitements ».
Elle est finalement revenue sur ses déclarations, en affirmant le 1er août 2012 que « C’est au laboratoire Roche de demander l’autorisation de mise sur le marché de l’ Avastin® pour traiter la DMLA. » Une demande qui a peu de chances d’aboutir en raison de liens financiers entre ce laboratoire, qui commercialise la molécule pour traitement du cancer, et le laboratoire Novartis qui s’occupe de la diffusion du traitement contre la DMLA.
Depuis 2009, Roche est propriétaire du laboratoire qui a mis au point la molécule contenue dans les deux médicaments et perçoit donc de l’argent provenant de son utilisation par une entreprise concurrente. C’est pourquoi financièrement, Roche n’aurait aucun intérêt à commercialiser un médicament moins cher qui entraverait une rentrée d’argent provenant des ventes de son concurrent.
Pour l’Assurance Maladie en revanche, la facture risque d’être salée si les praticiens hospitaliers n’utilisent plus que le Lucentis®, qui coûte 40 fois plus cher que l’Avastin®.
En savoir plus
-
Point sur l’utilisation de la spécialité Avastin® par voie intra oculaire, Ministère en charge de la santé, le 30 juillet 2012.
- Sur Le Figaro.fr
- "Cécité : Touraine esquive le problème de l'Avastin", par Martine Perez le 1er août 2012. - Sur Allodocteurs.fr
- Traitement de la DMLA : la polémique
- La DMLA
- Malvoyance due à la DMLA : il vous reste trois jours pour la dépister !
