Etats-Unis : nouvelle indication pour le Lucentis®
L'Agence américaine du médicament (FDA) a autorisé l'utilisation du médicament Lucentis® (ranibizumab injectable) pour le traitement de l'œdème maculaire diabétique, a annoncé le 13 août 2012 le laboratoire qui le commercialise.
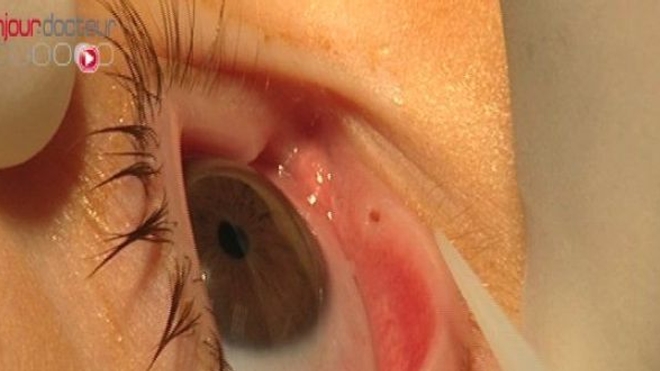
L'œdème maculaire diabétique (OMD) est une des complications oculaires causées par le diabète. Elle se traduit par une hyperperméabilité des capillaires sanguins de la rétine, ce qui entraîne la formation d'un œdème. Peu à peu, la vision va diminuer proportionnellement avec l'augmentation de la taille de l'œdème. Cela conduit très progressivement vers la cécité.
En autorisant son utilisation contre l'OMD, la FDA fait du ranibizumab le premier médicament habilité à traiter cette maladie. Le traitement courant de l'OMD est une intervention au laser qui permet de stabiliser la vision.
En France, le ranibizumab dispose d'une autorisation de mise sur le marché (AMM) pour le traitement de la dégénérescence maculaire liée à l'âge (DMLA).
Actuellement, il est au cœur de l'actualité car la Direction générale de la santé a demandé le 30 juillet 2012 l'interdiction de l'Avastin®, un anticancéreux, ayant les mêmes effets que le Lucentis®, mais dont l'autorisation de mise sur le marché ne concerne que le traitement de certains cancers, digestifs notamment.
En savoir plus
Sur Allodocteurs.fr :
Ailleurs sur le web :
- Roche.com
- "FDA approves Lucentis (ranibizumab injection) for treatment of diabetic macular edema", 13 août 2012
